Nierentransplantation
Neben der Hämodialyse und der Peritonealdialyse stellt die Nierentransplantation die dritte und wichtigste Möglichkeit der Nierenersatztherapie dar. Nur durch sie wird eine völlige Wiederherstellung der Nierenfunktion erreicht. Warum wird dann nicht häufiger eine Nierentransplantation durchgeführt, und weshalb muss man sich diesen Schritt reiflich überlegen? Es gibt verschiedene Gründe:
1. Der Mangel an Spendernieren und die damit stetig zunehmende Wartezeit
2. Gewisse Risiken (z.B. Infektionen, u.U. Wiederauftreten der Erkrankung im
Transplantat)
3. Der Körper nimmt ein fremdes Organ nicht ohne weiteres an
Immunologische Voraussetzungen>
Das Abwehrsystem (= Immunsystem) des Körpers hat die Aufgabe körpereigenes Gewebe (z.B. Blutzellen) von in den Körper eingebrachten „Fremdmaterial“ (Bakterien, Viren, transplantierte Organe…) zu unterscheiden und eine Immunreaktion zur Abwehr bzw. Vernichtung dieses fremden Materials einzuleiten. Dies ist normalerweise ein sehr nützlicher Prozess, der verhindert dass wir an z.B. einer banalen Lungenentzündung versterben. Leider kann das Immunsystem nicht unterscheiden, wenn gelegentlich körperfremdes Gewebe (z.B. eine Niere) zum Nutzen des Patienten eingebracht wird. Alles was unser Immunsystem als „fremd“ erkennt wird bekämpft.
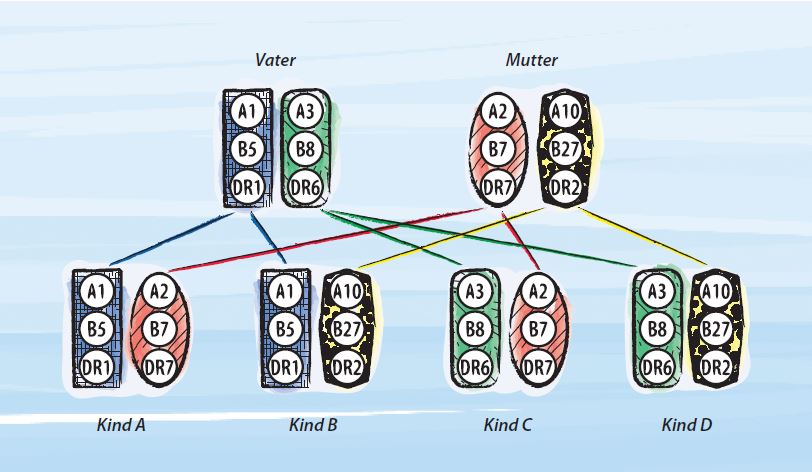
Ein wichtiges Beispiel ist die Übertragung von Blut. Es gibt bekannterweise verschiedene Blutgruppen (A, B, AB, 0) mit Rhesus-Faktor negativ oder positiv, die bei der Bluttransfusion berücksichtigt werden müssen. Es ist meist nicht schwierig gruppengleiches Blut zu finden. Ungleich komplizierter ist die Situation bei der Verpflanzung eines Organs wie der Niere, der Leber oder des Herzens, denn deren Zellen enthalten viel mehr Merkmale (die das Immunsystem erkennt) als die zellkernfreien roten Blutkörperchen. Diese Merkmale (HLA- Antigene) werden vererbt. Es gibt drei Gen-Loci (A, B und DR, alle auf dem Chromosom 6). Auf jedem dieser 3 Gen-Loci befinden sich jedoch zahlreiche verschiedene Ausbildungs-formen (Allele) z.B. für das Merkmal A: A1, A2, A3… Jeder Mensch besitzt pro Gen-Lokus zwei verschiedene Allele, im folgenden Schema der Vater A1 + A3 / B5 + B8 / DR1 + DR6. Ein Kind erhält genau die Hälfte der Allele von der Mutter, die andere vom Vater. Prinzipiell gibt es verschiedene Möglichkeiten:
Kind A ist mit den Geschwistern B und C halbidentisch, aber von D völlig verschieden. Ein Geschwister könnte jedoch auch dieselbe HLA- „Gruppe“ wie Kind A besitzen (hier A1). Jedes Kind ist mit Vater und Mutter halbidentisch.
Weil es so viele Allele (Ausprägungsformen) pro Gen-Lokus gibt, ist es ganz unwahrscheinlich, dass ein Nachbar oder eine andere nicht verwandte Person genau dasselbe HLA-Muster hat. Ein identischer HLA-Typ wäre natürlich eine ideale Voraussetzung für eine Transplantation, aber das ist unter nicht-verwandten Spendern unwahrscheinlicher als die berühmten „sechs Richtige“ im Lotto.
Inzwischen ist es durchaus möglich Organe von Menschen mit ungleicher Blutgruppe zu transplantieren, viel wichtiger ist eine möglichst geringe Ungleichheit der HLA-Antigene um zu verhindern, dass Antikörper gebildet werden, die die neue Niere schädigen. Aber auch hier wird durchaus diskutiert, ob dieses Dogma verlassen werden könnte und man statt dessen auf eine möglichst schnell erfolgte Zuteilung und Transplantation unter Vermeidung von allzu langer „kalter Ischämiezeit“ (die Zeit in der das Organ nicht durchblutet ist und kalt konserviert wird) hinarbeitet. Dies ist aber bei dem derzeitigen System der Zuordnung von Transplantatorganen über Eurotransplant eine eher schwierig organisierbare Angelegenheit (Gerechtigkeit der Organverteilung).
Mittels der Unterdrückung der Abwehrreaktion des Körpers auf das fremde Organ (Immunsuppression) kann heutzutage eine Transplantation unter nicht-verwandten Personen vorgenommen werden. Dies stellt die eigentliche Grundlage der Organtransplantationen dar, ist allerdings auch mit einer Vielzahl von Problemen und Nebenwirkungen behaftet. Bei jeder Transplantation wird versucht, die Anzahl der Nichtübereinstimmungen der Oberflächenantigene möglichst gering zu halten. Neben der möglichst guten Gewebeübereinstimmung zwischen Spender und Empfänger sind weitere Faktoren zu beachten, möglichst keine Vorimmunsierung durch frühere Bluttransfusionen oder frühere Transplantation des Empfängers, die das Risiko einer Transplantatabstoßung durch eine vermehrte Aktivität des Immunsystems erhöhen.
Woher kommen die Organe?
Als Nierenspender kommen, wie bereits erwähnt, sowohl Verwandte (Lebendspende, bei Kindern ist dies häufig ein Elternteil) oder aber Verstorbene (Leichenspende) in Betracht. Die Organspender müssen folgende Vorbedingungen erfüllen:
# Bei der Leichennierenspende sollte der Verstorbene (gesicherter Hirntod!) möglichst bis zuletzt eine stabile Kreislauffunktion gehabt haben. Generell sollen beim Organspender keine Infektionen, keine bösartigen Geschwulsterkrankungen, kein Bluthochdruck und keine Nieren- oder schwere Stoffwechselprobleme bestehen. Der gesicherte Hirntod wird von zwei verschiedenen Ärzteteams zu zwei verschiedenen Zeitpunkten festgestellt. Diese Ärzteteams stehen in keiner Weise mit einem Transplantationszentrum in Verbindung.
# Wenn ein verstorbener Patient die Einwilligung zur Organentnahme vor seinem Tod, oder die Verwandten nach seinem Tod gegeben hat, entscheidet der Computer von Eurotransplant ohne Rücksicht auf Herkunft, der Versicherungsart oder des sozialen Status wer dieses Organ bekommen soll. Solche Details über den Empfänger sind Eurotransplant nicht bekannt. Hier zählt allein die Wartezeit, die ein nierenkranker Patient bereits hat und ob seine Blutgruppe passt und die HLA Antigene mit denen des Spenders möglichst gut übereinstimmen
# Ein möglicher Lebendspender muss körperlich und psychisch gesund sein, damit sicher- gestellt ist, dass er nach der Entnahme einer Niere keinen Schaden nimmt und ohne wesentliche Einschränkungen mit der verbleibenden Niere leben kann. Neben einigen einfachen Untersuchungen und der Bestimmung (Typisierung) der HLA-Merkmale sind daher ein Gespräch mit einem Psychologen und u.a. eine Darstellung der Nierengefäße meist mittels Gefäßdarstellung durch Kernspintomographie erforderlich.
# Bei einer Lebendspende, die ja langfristig geplant wird, ist auch eine Blutgruppen inkompatible Spende (ABO inkompatible Spende) und Transplantation an unserem Zentrum möglich. Eine durch Blutgruppenantikörper ausgelöste Abstoßung muss man nur in den ersten zwei Wochen nach der Transplantation fürchten. In dieser Zeit müssen die Antikörper-Spiegel im Blut des Empfängers (sog. Antikörper-Titer) gegen die fremde Blutgruppe natürlich ganz niedrig gehalten werden. Danach hat der Patient im Vergleich mit den anderen transplantierten Patienten kein erhöhtes Abstoßungsrisiko mehr. Hierzu macht man sich die Gabe eines monoklonalen Antikörpers zu nutze, der über Monate die Produktion von Antikörper effektiv unterdrücken kann (Rituximab, Mabthera). Aber auch bestehende Antikörper müssen vor der Transplantation mittel einer speziellen „Dialyseform“, der Immunadsorption entfernt werden. 4 Wochen vor der geplanten Transplantation erhalten die Patienten meist nur einmalig Rituximab und einige Tage vor der Transplantation eine Infusion mit Immunglobulinen. In der Woche vor der Transplantation und auch in den ersten 14 Tagen nach Transplantation wird eine Immunadsorptionsbehandlung zur Entfernung von Blutgruppenantikörpern durchgeführt. Ansonsten erhält der Patient die üblich immunsuppressive Behandlung (siehe unten).
# Vor der Organentnahme sind noch bestimmte Laboruntersuchungen sowie die Blutentnahme zur Gewebetypisierung erforderlich. Die Organentnahme muss äußerst sorgfältig durchgeführt werden, damit die Zeitdauer ohne Organdurchblutung (von der Entnahme aus dem Verstorbenen bis zur Einpflanzung) möglichst kurz ist und damit die Niere so wenig wie möglich geschädigt wird.
Transplantationsvorbereitung
Im Rahmen der Transplantationsvorbereitung werden die Patienten zunächst gründlich untersucht, um Kontraindikationen und Zustände, die den Transplantationserfolg gefährden könnten, zu erkennen und gegebenenfalls durch vorbereitende Behandlungsmaßnahmen zu beseitigen. Dazu gehören vor allem Untersuchungen von Herz, Lungen, Leber, Gallengängen, Nieren, Harnwegen, Blase sowie Knochen, Nerven, Augen und Gehör. Vielleicht ist vorher auch noch eine Operation, z.B. die Entfernung einer chronisch infizierten Niere nötig.
Im weiteren müssen vor der Immunsuppression die üblichen Impfungen (Kinderlähmung, Tetanus, Diphterie, Masern, Mumps, Röteln, Hirnhautentzündung, Gelbsucht [Hepatitis A,B], Windpocken) durchgeführt werden, da nach begonnener Immunsuppression die Impferfolge schlechter sind, oder aber eine Impfung nicht mehr möglich ist (mit Lebendimpfstoffen). Ergänzend wird der Immunstatus geprüft. Wichtig ist hierbei, ob der Patient bereits eine Cytomegalievirus (CMV)- Infektion durchgemacht hat oder nicht. Der Großteil der Kinder hat mit diesem Erreger während seines Lebens, meist ohne etwas davon zu merken, Kontakt gehabt. Eine CMV- positive Spenderniere bei CMV- negativen Empfänger stellt ein erhöhtes Risiko dar und erfordert nach der Transplantation eine engmaschige Kontrolle, da unter der Immunsuppression die Gefahr einer ernsthaften CMV-Erkrankung besteht. Auch eine akute Ebstein-Barr-Virus Infektion (EBV) kann nach Organtransplantationen und unter Immunsuppression Probleme bereiten. Im schlimmsten denkbaren Fall, dies aber zum Glück nur in seltenen Ausnahmefällen, kann es sogar zur Entwicklung einer Tumorerkrankung kommen.
Schließlich sollen auch die Patienten selbst für die Transplantation günstige Voraussetzungen schaffen (gute Rehabilitation, zuverlässige Medikamenteneinnahme, positive Einstellung zur Transplantation). Eine gute Zusammenarbeit (Compliance) zwischen Patient, Eltern und dem Ärzte- und Schwesternteam ist für eine erfolgreiche Transplantation unbedingt notwendig.
Sobald die Patientenunterlagen dem Transplantationsteam vorgelegt wurden, erfolgt die Typisierung und Antikörperbestimmung im Blut. Anschließend kommt es zu einer persönlichen Vorstellung mit dem gesamten Transplantationsteam (Chirurgie, Tx-Beauftragte, Kindernephrologe) und danach wird der Patient auf die Transplantations-Warteliste bei Eurotransplant in Leiden gesetzt. Jetzt sollte der Patient immer erreichbar sein, und die Familie detailliert dem Transplantations-Zentrum Erreichbarkeiten mitteilt. Auch eventuelle Urlaube, oder andere Auslandsaufenthalte sollte dem Transplantationszentrum immer mitgeteilt werden.
Das Transplantations-Angebot kommt plötzlich und häufig unerwartet, daher sollten die entsprechenden Personen immer über den Aufenthaltsort des Patienten informiert sein. Die Wartezeit ist vorher nicht berechenbar, manchmal dauert es nur wenige Wochen oder Monate, in wenigen Fällen aber sogar Jahre, bis es zur Transplantation kommt. Dies ist von den einzelnen Oberflächenantigenen, die ja möglichst gut mit denen des potentiellen Spenders übereinstimmen sollten, abhängig. Die durchschnittliche Wartezeit der Kinder liegt derzeit aber leider bei 22 – 26 Monaten und bei Patienten mit der Blutgruppe O, die einen Spender mit der Blutgruppe O benötigen sogar noch deutlich höher.
Operative Technik bei der Nierentransplantation
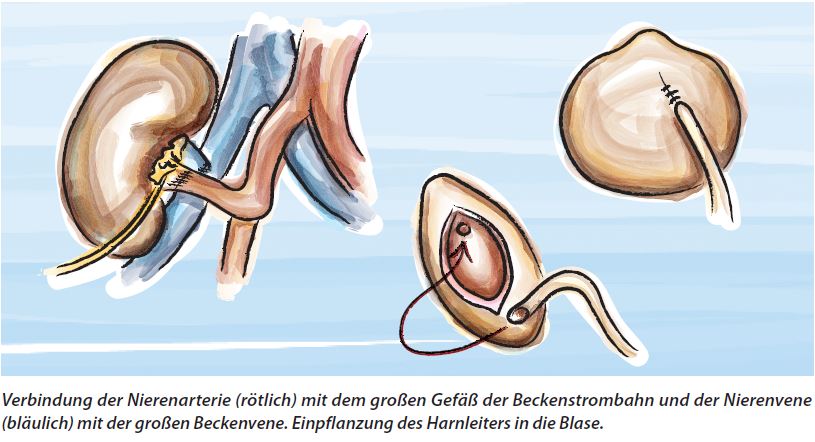
Die Operation dauert gut drei Stunden, gelegentlich auch länger, besonders wenn noch die alten Nieren entfernt werden müssen. Bei der Verpflanzung werden die Nierengefäße an die Körper- oder Beinschlagader und die entsprechende Vene angeschlossen, sowie der Harnleiter der Spenderniere in die Harnblase eingesetzt. Um einen guten Abfluss zu gewährleisten, wird anfangs ein Blasenkatheter sowie ein sog. Doppel-J-Katheter gelegt, der den Harnleiter zwischen Nierenbecken und Blase schient, ferner einige Schläuche (Drainagen), die bald entfernt werden.
 Nach der Operation wird der Patient zur Überwachung auf eine Intensivstation (Chirurgie oder
die Kinderintensivstation) verlegt. Die Flüssigkeitszufuhr und Urinausscheidung muss genau
kontrolliert werden. Bei gutem Verlauf erfolgt bei Kleinkindern am zweiten Tag nach
Operation die Verlegung auf eine Station der Kinderklinik, wenn ein Elternteil die Niere
gespendet hat, bleiben die größeren Kinder und Jugendlichen auf der Station der
chirurgischen Universitätsklinik bis das Elternteil entlassen wird und werden danach bis zur
eigenen Entlassung (circa 3 Wochen nach Transplantation) auf die Kinderstation verlegt. Bei
kleineren Kindern werden Eltern und Kind meist frühzeitiger auf die Kinderstation
aufgenommen.
Nach der Operation wird der Patient zur Überwachung auf eine Intensivstation (Chirurgie oder
die Kinderintensivstation) verlegt. Die Flüssigkeitszufuhr und Urinausscheidung muss genau
kontrolliert werden. Bei gutem Verlauf erfolgt bei Kleinkindern am zweiten Tag nach
Operation die Verlegung auf eine Station der Kinderklinik, wenn ein Elternteil die Niere
gespendet hat, bleiben die größeren Kinder und Jugendlichen auf der Station der
chirurgischen Universitätsklinik bis das Elternteil entlassen wird und werden danach bis zur
eigenen Entlassung (circa 3 Wochen nach Transplantation) auf die Kinderstation verlegt. Bei
kleineren Kindern werden Eltern und Kind meist frühzeitiger auf die Kinderstation
aufgenommen.
Immunsuppressive Therapie
Nach der Transplantation ist eine Behandlung mit dem Ziel der weitgehenden Unterdrückung einer Abstoßungsreaktion unumgänglich. Gleichzeitig werden dadurch auch andere Abwehrreaktionen z.B. gegen Infektionen behindert.
Zur Zeit stehen folgende Medikamente zur Verfügung, die stetig eingenommen werden müssen:
# Cyclosporin A (Sandimmun-Optoral) wird aus einem Pilz gewonnen. Eines der wichtigsten Medikamente heutzutage, aber leider nicht ohne Nebenwirkungen (Nierenschädigung, Zahnfleischwucherung, vermehrte Körperbehaarung), daher sind engmaschige Blutspiegelkontrollen notwendig.
# Tacrolimus (Prograf) wird ebenfalls aus einem Pilz gewonnen, noch potenter als das Cyclosporin A. Es wird eingesetzt, wenn es zu starken Cyclosporin A Nebenwirkungen kommt, oder falls es unter Cyclosporin zu Transplantat Abstoßungen gekommen ist. Auch hier gibt es leider Nebenwirkungen, wobei v.a. Dingen starkes Zittern, oder sogar Krampfanfälle im Vordergrund stehen.
# Prednison, eine dem natürlichen Nebennierenhormon Cortisol verwandte Substanz. Seine Nebenwirkungen sind bei längerer Anwendung Vollmondgesicht (Cushing), Appetit- und Gewichtssteigerung, Akne und Wachstumsstörung. Wir bemühen uns um eine möglichst frühzeitige Reduktion der Dosis, setzen das Medikament meist nach 6-12 Monaten wieder ab.
# Mycophenolat-Mofetil (Cellcept, Myfortic) ist ein spezifischer Hemmer der T- und B-Zell Bildung, der seit einigen Jahren zur immunsuppressiven Therapie verfügbar ist. Damit konnte die Zahl akuter Abstoßungen wesentlich verringert werden. Hauptnebenwirkungen sind rezidivierende Durchfälle.
# Basiliximab (Simulect): ist ein therapeutischer humanisierter monoklonalen Antikörper gegen den Interleukin-2-Rezeptor (CD25), der in der immunsuppressiven Behandlung akuter Abstoßungsreaktionen nach Nierentransplantationen eingesetzt wird.
# Sirolimus (Rapamune), Everolimus (Certican): Beide Substanzen bezeichnet man auch als mTOR Inhibitoren (mammalian Target of Rapamycin, etwa „Ziel des Rapamycin im Säugetier“). Die Hemmung von mTOR hat zur Folge, dass sowohl die Aktivierung als auch das Voranschreiten der T-Zellen von der G1-Phase in die S-Phase des Zellzyklus verhindert wird. Everolimus wird bei einigen Patienten eingesetzt um die Dosis von Cyclosporin reduzieren zu können, aber auch in Kombination mit MMF und Steroiden wird es eingesetzt. Sirolimus hat aufbauend auch auf einer längeren Halbwertszeit ein höheres Nebenwirkungspotential und wir setzen diese Substanz eher selten ein (NW: Proteinurie, Wunderheilungsstörungen).
Diese immunsuppressiven Medikamente werden meist kombiniert und können daher mit der Zeit geringer dosiert werden. Dadurch können die Nebenwirkungen verringert werden. Die Medikamente müssen in den ersten Wochen nach der Transplantation in recht hohen Dosen verabreicht werden, da die Hauptgefahr einer akuten Abstoßungsreaktion zu diesem Zeitpunkt am größten ist. Sollte es dennoch zu einer Transplantatabstoßung kommen, was nicht selten vorkommt, ist oft zuerst eine noch intensivere Therapie (Hochdosis-Prednisontherapie) nötig. Bei Nichtansprechen wird nach Durchführung einer Nierenbiopsie zur Bestätigung der Abstoßung z.B. ATG (Antilymphocytenglobulin), eingesetzt. Bei Antikörper ausgelöster Transplantatproblematik (der Patient reagiert auf eines der Spenderoberflächenantigene) wird z.B. Rituximab, ein Antikörper, der ursprünglich für die Therapie von bösartigen Erkrankungen des lymphatischen Systems (Lymphdrüsenkrebs, maligne Lymphome) entwickelt wurde und innerhalb der vielen Zellen des lymphatischen Systems eine einzige Zellreihe, nämlich sogenannte B-Zellen (B-Lymphozyten noch genauer: Zellen mit dem Merkmal CD20) ausschaltet, eingesetzt. Zudem könnte eine spezielle Dialyseform, Plasmapherese, oder auch Immunadsorption, zur Anwendung kommen. Die beschriebenen Medikamente sind sehr starke und teure Präparate und können auch mit deutlichen Nebenwirkungen vergesellschaftet sein. In den letzten Jahren mussten wir diese Medikamente eher selten einsetzen. Meist wird zuerst die immunsuppressive Medikation von Cyclosporin auf Tacrolimus umgesetzt. Eine erste Routinenierenbiopsie erfolgt aber oft 6 Monate nach der Transplantation.
Da im Verlauf der Erkrankung viele Patienten schon Kontakt mit fremdem Eiweiß hatten (Transfusion, frühere Transplantation) stehen wir manchmal vor dem Problem der „Immunisierung“. Das heißt, der Patient hat schon Antikörper gegen dieses fremde Eiweiß bevor die neue Niere seinen Körper überhaupt betritt. In einem solchen Fall muss man vor der Transplantation mittels Plasmapharese (eine spezielle Form der Blutwäsche) diese Antikörper herausfiltern und die Gefahr für das neue Organ möglichst gering halten. Bei der Plasmapharese werden auch „gute“ Eiweißstoffe herausgefiltert, z.B. Immunglobuline, die dann anschließend wieder zurückgegeben werden. Manchmal ist es auch notwendig ständig neu produzierte Antikörper über eine lange Zeit immer wieder mittels Plasmapharese aus dem Körper zu entfernen.
Nachkontrollen
In den ersten Wochen müssen aus den oben erwähnten Gründen die Blutwerte insbesondere von Kreatinin und Harnstoff täglich und der Blutspiegel von Cyclosporin bzw. Prograf (zur Vermeidung einer Über- oder Unterdosierung) mehrfach wöchentlich bestimmt werden.
Die Klinikentlassung erfolgt, bei komplikationslosem Verlauf, meist 3-4 Wochen nach der Transplantation. Sollte es zu einer akuten Abstoßungsreaktion gekommen sein, so könnte sich der Krankenhausaufenthalt verlängern. Die weiteren Kontrollen finden anfangs zweimal, dann einmal wöchentlich, im zweiten Jahr alle 2 Wochen und im Weiteren dann alle 3-4 Wochen statt. Auch später sind regelmäßige Kontrollen erforderlich. Wichtig ist aber, dass der Patient sich sofort bei Fieber, Unwohlsein, Schmerzen im Bereich des Transplantats oder Urinrückgang meldet. Die Ursachen hierfür sind natürlich vielfältig. Häufig handelt es sich um eine banale Grippe, aber auch eine schwerwiegende Viruserkrankung (CMV-Infektion) oder eine Abstoßungsreaktion kann sich dahinter verbergen. Daher muss der Nierenspezialist unbedingt sofort informiert werden.
Komplikationen der Nierentransplantation
Früher kam es bei der Mehrzahl der Nierentransplantierten zu einer akuten Abstoßungsreaktion, die umso heftiger verläuft, je früher sie auftritt. Heutzutage, unter Optimierung der immunsuppressiven Therapie werden solche Abstoßungsreaktionen eher selten gesehen. In der Regel können sie erfolgreich behandelt werden. Im Weiteren kann es und wird es zu einer chronischen Abstoßung kommen, gekennzeichnet durch langsamen Verlauf (Monate bis Jahre) mit einem allmählichen Kreatininanstieg und dann erneuter Nierenfunktionseinschränkung. Dies bedeutet ganz klar: auch der transplantierte Patient bleibt Patient und wird wieder Dialysepatient werden!
Zeichen der akuten Transplantatabstoßung sind:
- Funktionsverschlechterung der Niere mit Anstieg von Kreatinin und Harnstoff im Blut
- Blutdruckanstieg
- Rückgang der Urinausscheidung
- Vermehrte Eiweißausscheidung im Urin
- Fieber
- Druckgefühl im Bereich des Transplantats
- Nierenschwellung im Ultraschall
Als weitere mögliche Komplikationen sind zu erwähnen: Eine operationsbedingte Abflussstörung im Harnleiter mit Rückstau des Urins ins Nierenbecken, eine Nierengefäßverengung, eine Hepatitis Infektion vom Spender auf den Empfänger und eine CMV-Erkrankung, welche grippeähnliche Symptome aufweist (Bindehautentzündung, Schnupfen, Husten, Fieber), möglicherweise mit Leberbeteiligung. Generell besteht eine erhöhte Infektgefahr unter Immunsuppression. Auch rezidivierende Harnwegsinfekte, verbunden mit einem sog. Vesikoureteralen Reflux (der Urin läuft bei Blasenentleerung stets auch wieder zurück ins Nierenbecken) können die Transplantatniere schädigen.
Ergebnisse nach Nierentransplantation
Die Chancen für das Überleben einer transplantierten Niere eines eineiigen Zwillings sind fast 100%, aber eine solche Niere steht natürlich nur selten zur Verfügung. Bei nicht verwandten Spendern beträgt die Wahrscheinlichkeit, dass die transplantierte Niere nach einem Jahr noch funktioniert gegenwärtig ca. 85% und nach zwei Jahren 80%. Die Verlustrate ist im ersten Jahr am größten. Auch später kann eine Niere noch verloren gehen. Wenn sie jedoch nach fünf Jahren tadellos funktioniert, ist zu erwarten, dass sie dies auch noch nach 10-15 oder bei einer Lebendspende auch nach mehr Jahren tun wird. Sollte es doch zu einem Versagen des Transplantats kommen, wird wieder eine Dialysebehandlung durchgeführt bis eine erneute Transplantation möglich ist.
Zunkunftsaussichten
Die Zunahme der Dialysepatienten bei stagnierendem Spenderangebot hat zu einer drastischen Verlängerung der Wartezeit auf eine Nierentransplantation geführt. Derzeit warten 4-5 mal so viele Patienten auf eine Niere wie jährlich in Deutschland transplantiert werden können. Obwohl > 65% der deutschen Bevölkerung zu einer Organspende prinzipiell bereit wären, besitzen lediglich 3% einen Spenderausweis. Hier ist noch viel Aufklärungsarbeit zu leisten. Die Situation hat sich trotz vielseitiger Medienberichte und grossen Einsatz der Deutschen Stiftung Organtransplantation in letzter Zeit leider nicht wesentlich gebessert. Deutschland hinkt mit 14,4 Organspendern pro Million Einwohnern deutlich im europäischen Durchschnitt hinterher (Spanien: 36 Spender pro Million Einwohner). Auch die Wartezeiten der Kinder sind im europäischen Durchschnitt erschreckend lang (Deutschland 22 – 26 Monate, Spanien, Frankreich 3-4, bis höchstens 6 Monate). Auch die Priorität der Kinder auf der Warteliste ist in vielen Ländern viel besser, als in Deutschland!
Auch deswegen plädieren wir vermehrt für die Lebendspende. Nach Einführung des neuen Transplantationsgesetzes hat diese Möglichkeit vor allem bei den Kindern (Eltern/Ver-wandtenspende) zu einer gewissen Entspannung der Situation beigetragen. In vielen Zentren, so auch in Köln, liegt der Anteil der Lebendspende bei 50 % oder höher!
Es besteht die berechtigte Hoffnung auf den Körper insofern einzuwirken, dass er eine transplantierte Niere nicht mehr als „fremd“ erkennt und abzustoßen versucht. Gelänge es, eine solche Immuntoleranz zu erzeugen, wäre keine lebenslängliche Immunsuppression mit all ihren Problemen mehr erforderlich. Forschungen auf diesem Gebiet finden weltweit statt und bringen fast täglich neue Erkenntnisse, wann aber die Erzeugung einer Immuntoleranz beim Menschen möglich sein wird ist heute noch ungewiss. Viele Fortschritte werden auch den Bereich der immunsuppressiven Medikamente betreffen, hier sind in nächster Zeit nebenwirkungsärmere und bessere Immunsuppressiva zu erwarten.
Es wäre aber verfehlt, nur auf eine bessere Zukunft zu hoffen und einfach abzuwarten. Im Gegenteil, ein gesunder Optimismus ist unentbehrlich, den brauchen wir alle!